吉瑞替尼(gilteritinib)说明书
通用名:gilteritinib
商品名:Xospata
全部名称:吉瑞替尼,富马酸吉列替尼,吉列替尼,吉特替尼,gilteritinib,Xospata
适应症:
XOSPATA是一种激酶抑制剂,用于治疗复发或难治性急性髓系白血病(AML)合并FLT3的成人患者。
用法用量:
每天口服一次,每次120毫克。
不良反应:
最常见的不良反应(≥20%)为肌痛/关节痛、转氨酶升高、疲劳/不适、发热、非感染性腹泻、呼吸困难、水肿、皮疹、肺炎、恶心、口腔炎、咳嗽、头痛、低血压、头晕和呕吐。
禁忌:
对吉特替尼或任何赋形剂过敏。
注意事项:
后部可逆性脑病综合征(PRES):发生PRES的患者停止XOSPATA。
延长QT间期:中断和减少QTcF>500msec的XOSPATA住院患者的剂量。纠正XOSTATA给药前和期间的低钾血症或低镁血症。
胰腺炎:在发展为胰腺炎的患者中中断和减少剂量。
胚胎胎儿毒性:XOSPATA可导致胎儿损伤
给孕妇服用的告知胎儿的潜在风险,并使用有效的避孕方法。
贮藏:
将XOSPATA片在20℃至25℃(68°F至77°F)下储存;允许在15℃至30℃之间移动(59°F至86°F)
保存在原始容器中。
作用机制:
Gilteritinib是一种抑制多受体酪氨酸激酶的小分子,包括FMS样酪氨酸激酶3(FLT3)。Gilteritinib对外源性表达FLT3的细胞FLT3-ITD、酪氨酸激酶结构域突变(TKD)FLT3-D835Y和FLT3-ITD-D835Y具有抑制FLT3受体信号转导和增殖的能力,并诱导表达FLT3-ITD的白血病细胞凋亡。
安全与疗效:
基于III期ADMIRAL试验的结果,该试验调查了Xospata与挽救性化疗治疗复发性或难治性FLT3mut+AML患者的疗效和安全性。结果显示,与挽救性化疗组相比,Xospata治疗组患者总生存期显著延长、一年生存率提高一倍、伴有完全或部分血液学恢复的完全缓解率提高一倍。安全性方面,Xospata治疗组最常见的≥3级不良事件为发热性中性粒细胞减少、贫血、血小板减少。
在2018年10月,Xospata率先在日本获得批准,用于治疗FLT3突变的复发或难治性AML成人患者。2018年11月底,Xospata获美国FDA批准,成为用于复发性或难治性AML患者群体的首个FLT3靶向制剂,也标志着安斯泰来进入了美国血液癌症治疗领域。2019年5月,FDA批准了Xospata的一份补充新药申请(sNDA),更新Xospata的美国产品标签,纳入来自III期ADMIRAL试验的最终OS数据。在欧盟,Xospata于2019年10月获得批准,单药治疗携带FLT3突变(FLT3mut+)的复发性或难治性AML成人患者。
温馨提示:
1.如果您发现该药品信息有任何错误,请联系我们修改,我们将热忱感谢您的批评指正!
2.本站所表达的任何关于疾病的建议都不应该被视为医生的建议或替代品,请咨询您的治疗医生了解更多细节。本站信息仅供参考!
注意事项:
后部可逆性脑病综合征(PRES):发生PRES的患者停止XOSPATA。
延长QT间期:中断和减少QTcF>500msec的XOSPATA住院患者的剂量。纠正XOSTATA给药前和期间的低钾血症或低镁血症。
胰腺炎:在发展为胰腺炎的患者中中断和减少剂量。
胚胎胎儿毒性:XOSPATA可导致胎儿损伤
给孕妇服用的告知胎儿的潜在风险,并使用有效的避孕方法。
作用机制:
Gilteritinib是一种抑制多受体酪氨酸激酶的小分子,包括FMS样酪氨酸激酶3(FLT3)。Gilteritinib对外源性表达FLT3的细胞FLT3-ITD、酪氨酸激酶结构域突变(TKD)FLT3-D835Y和FLT3-ITD-D835Y具有抑制FLT3受体信号转导和增殖的能力,并诱导表达FLT3-ITD的白血病细胞凋亡。
安全与疗效:
基于III期ADMIRAL试验的结果,该试验调查了Xospata与挽救性化疗治疗复发性或难治性FLT3mut+AML患者的疗效和安全性。结果显示,与挽救性化疗组相比,Xospata治疗组患者总生存期显著延长、一年生存率提高一倍、伴有完全或部分血液学恢复的完全缓解率提高一倍。安全性方面,Xospata治疗组最常见的≥3级不良事件为发热性中性粒细胞减少、贫血、血小板减少。
在2018年10月,Xospata率先在日本获得批准,用于治疗FLT3突变的复发或难治性AML成人患者。2018年11月底,Xospata获美国FDA批准,成为用于复发性或难治性AML患者群体的首个FLT3靶向制剂,也标志着安斯泰来进入了美国血液癌症治疗领域。2019年5月,FDA批准了Xospata的一份补充新药申请(sNDA),更新Xospata的美国产品标签,纳入来自III期ADMIRAL试验的最终OS数据。在欧盟,Xospata于2019年10月获得批准,单药治疗携带FLT3突变(FLT3mut+)的复发性或难治性AML成人患者。
 全部分类
全部分类


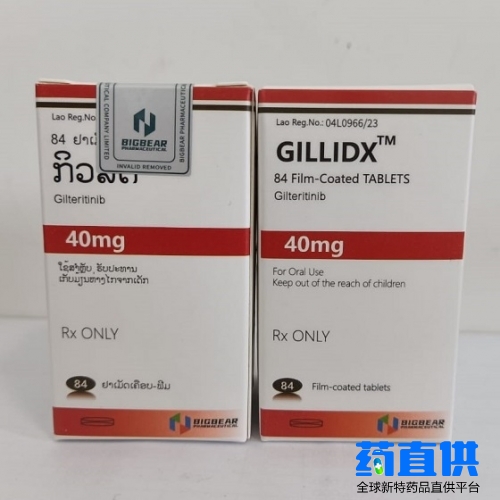
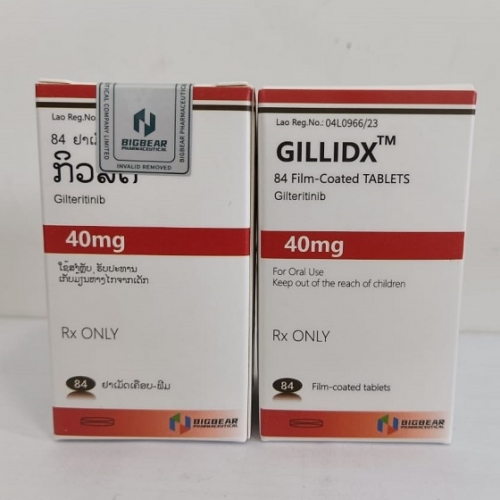
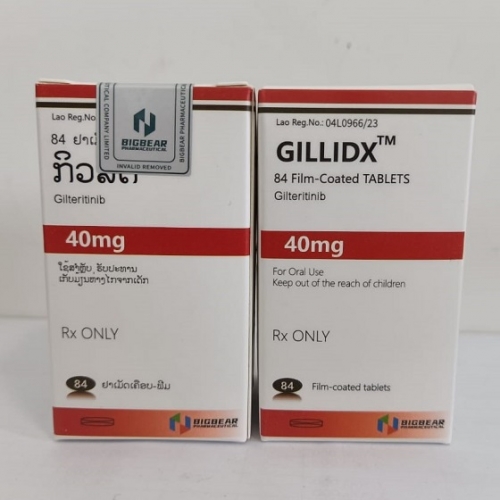
 吉列替尼
吉列替尼 老挝大熊制药
老挝大熊制药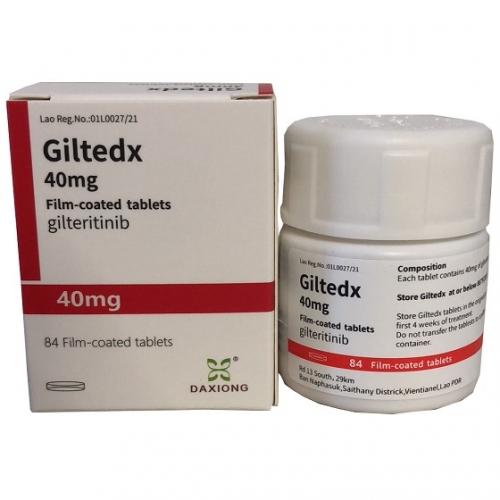
 用法用量
用法用量 粤ICP备2021070247号
粤ICP备2021070247号
