奥拉单抗(Olaratumab)是什么时候上市的,奥拉单抗(Olaratumab)于2016年10月31日获得美国食品和药品管理局(FDA)的批准上市。
奥拉单抗(Olaratumab)作为一种新型的药物治疗软组织肉瘤,在医学界引起了广泛关注。它的问世为患有这种恶性肿瘤的患者提供了新的希望。那么,奥拉单抗(Olaratumab)究竟是在什么时候上市的呢?以下将对此进行详细解答。
1. 奥拉单抗(Olaratumab)的商业化上市
奥拉单抗(Olaratumab)最早在2016年10月获得了美国食品药品监督管理局(FDA)的加速批准(Accelerated Approval),用于与化疗药物多西他赛(Doxorubicin)联合治疗特定类型的软组织肉瘤(STS)。这一决定是基于早期临床试验显示其在治疗这类肿瘤中的潜在益处。
2. 加速批准的背景和条件
FDA的加速批准是为了加快对那些满足临床需要且有潜在治疗优势的药物的上市进程。奥拉单抗(Olaratumab)在获得加速批准后,仍需进行进一步的研究确认其确切的临床效果和安全性。
3. 进一步研究和后续审批
随着进一步的临床研究数据积累,奥拉单抗(Olaratumab)面临着进一步的审批考验。在进行后续研究过程中,结果并不如预期,最终导致了对其有效性的质疑。
4. 市场情况和药物的未来
基于后续研究结果,FDA在2020年2月撤销了对奥拉单抗(Olaratumab)的加速批准。这一决定意味着该药物不再建议用于软组织肉瘤的治疗,而需进一步寻求新的治疗策略和药物选择。
总体而言,奥拉单抗(Olaratumab)的上市历程充满曲折,从最初的加速批准到后来的撤销,反映了药物研发与临床应用中所面临的挑战和不确定性。尽管如此,它依然为医学界提供了宝贵的经验教训,并鼓励着研究人员继续寻求更有效、更安全的治疗方式,以改善软组织肉瘤患者的生存率和生活质量。

 全部分类
全部分类

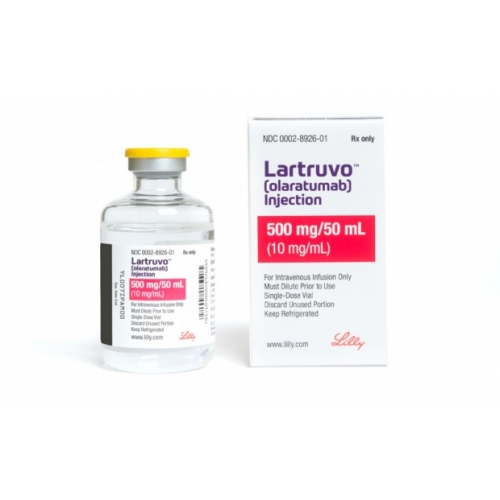
 美国礼来Lilly
美国礼来Lilly
 老挝大熊制药
老挝大熊制药
 老挝卢修斯制药
老挝卢修斯制药
 中国山东新时代药业
中国山东新时代药业
 中国齐鲁制药有限公司
中国齐鲁制药有限公司


 粤ICP备2021070247号
粤ICP备2021070247号
