SER-109(fecal microbiota spores, live-brpk)国内有没有上市,SER-109(fecal microbiota spores, live-brpk)于2023年4月27日获得美国食品药品监督管理局(FDA)的批准上市,目前国内未上市。
随着全球对抗耐药性菌株的需求增加,SER-109 (fecal microbiota spores, live-brpk)作为一种新兴的治疗方法备受关注。它是一种利用人类粪便中的微生物孢子来重建肠道微生态平衡的生物制剂,特别适用于治疗艰难梭菌感染(Clostridioides difficile infection, CDI)。对于这种治疗方法在中国的实际应用和市场上市情况,仍然存在一定的疑问和不确定性。
1. 中国市场现状
目前,SER-109在中国尚未正式上市。尽管其在美国和其他国家的临床研究显示出潜在的治疗效果和安全性,但其在中国的注册和市场准入流程尚未完成。这主要受到中国药品监管机构严格的审批要求和外国生物制剂进入市场的复杂性影响。
2. 临床研究与数据支持
关于SER-109在治疗艰难梭菌感染方面的临床研究数据显示,其通过恢复肠道健康的微生态平衡,有效减少了CDI的复发率。这一治疗策略在美国已经获得了FDA的批准,但在中国,尚需进行更多的本土化研究和临床试验以符合国内的法规和标准。
3. 市场前景与挑战
尽管SER-109具有潜力成为艰难梭菌感染治疗的新选择,但其在中国市场的推广面临诸多挑战。包括但不限于市场准入的时间成本、临床试验数据的本土化需求、以及医疗机构和患者对新兴生物制剂接受度的考量等因素,都需要综合考虑和解决。
4. 未来展望
随着中国生物制药市场的快速发展和政策环境的逐步优化,SER-109在未来可能会寻求更加快速和顺畅的市场准入途径。随着相关临床数据的积累和进一步的研究,相信其在中国市场的应用前景将逐步明朗化,为治疗艰难梭菌感染的患者带来新的希望和选择。
总体而言,尽管SER-109在全球范围内展现出了潜力和效果,其在中国市场上市仍面临多方面的挑战和待解决的问题。未来的发展将取决于多方合作、科学研究的深化以及政策环境的持续优化,以期为中国的患者提供更多创新和有效的治疗选择。
 SER-109的相关介绍
SER-109的相关介绍
注:本站所有内容仅供参考,不代表药直供立场(如有错漏,请帮忙指正),转载请注明出处。不作为诊断及治疗依据,不可替代专业医师诊断、不可替代医师处方。本站不承担由此导致的相关责任!
2025-02-26 13:34:03 更新
 全部分类
全部分类



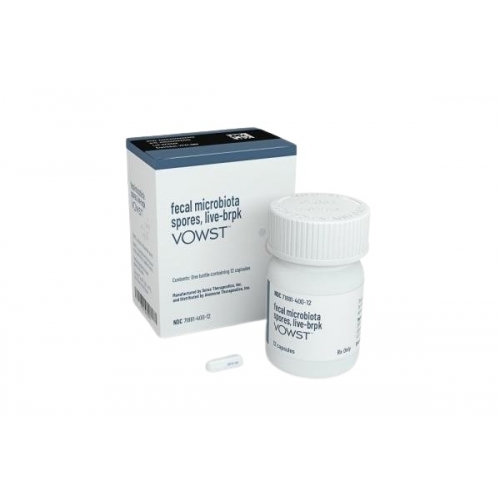
 美国Seres Therapeutics
美国Seres Therapeutics
 美国Human Genorne Sciences
美国Human Genorne Sciences
 德国Intendis
德国Intendis
 美国默沙东
美国默沙东
 印度natco
印度natco
 瑞士罗氏
瑞士罗氏
 印度Intas
印度Intas

 粤ICP备2021070247号
粤ICP备2021070247号
